
リニカルグループでは、コスト、タイムライン、試験規模、臨床試験戦略にあわせて、柔軟なデータマネジメントサービスを提供します。
臨床試験データマネジメントサービス
高品質なデータは、お客様の臨床試験の成功と薬事承認に不可欠です。データマネジメント (DM) は、患者様のデータを含め臨床試験に関連する機密情報のセキュリティを確保し、設けられたデータプライバシー規制を遵守する必要があります。リニカルのDM機能は、情報管理の完全性、信頼性、効率性を確保しながら、正確で実用的なデータをタイムリーに提供することを目的としています。
当社グループは、臨床試験全体を通じて効率的なデータマネジメントを実現するために必要な経験、リソース、プロセスを有しています。リニカルの20年近くにわたる臨床試験データ管理の経験は、北米、欧州、アジアでの試験に及び、第I相、第II相、第III相臨床試験から臨床研究において、数多くのグローバルプロジェクトに携わってきました。リニカルのデータマネジメントチームは、Medrio、Viedoc、Oracle、Medidata Raveなど業界トップのEDC(Electornic Data Caputure) プラットフォームを使用する専門知識を有しており、お客様固有のニーズに柔軟に対応いたします。
Service
end-to-endの包括的なデータマネジメント機能
リニカルの一括請負契約によるデータマネジメントサービスには以下のものが含まれます。
Explore
・CRFデザインとデータベース設計
・データマネジメント計画の立案と文書化
・データバリデーションとクエリ管理計画
・症例報告書入力マニュアルの作成
・EDCシステムの導入、施設へトレーニングおよびサポート
・メディカルコーディング (WHO-DD、MedDRA、医薬品データファイル)
・SAEデータの照合
・外部データの転送と照合
・継続的なデータの確認、記録および追跡
・データバリデーションとクリーンアップ
・データの品質保証
・データマネジメント報告書の作成
・CDISC(Clinical Data Interchange Standards Consortium)対応
・EDCシステムヘルプデスク対応
・データベースロックと監査対応
・クライアント要望のデータ規格(SAS、CDISC(SDTM、define.xml))を使用したデータベースのリリースなど
・文書の保管
- Medrio
- Viedoc
- Oracle
- Medidata Rave
お客様の専任パートナー
リニカルは、豊富な経験を技術や疾患領域の知識と組み合わせ、効率的なプロセス、実用的な結果、そして最高品質のデータを確保しています。プロジェクトの大小にかかわらず、リニカルのデータマネジメントチームは、お客様固有のニーズに耳を傾け、プロジェクトに対して最適な提案を行い、すべてのステップで付加価値を提供します。
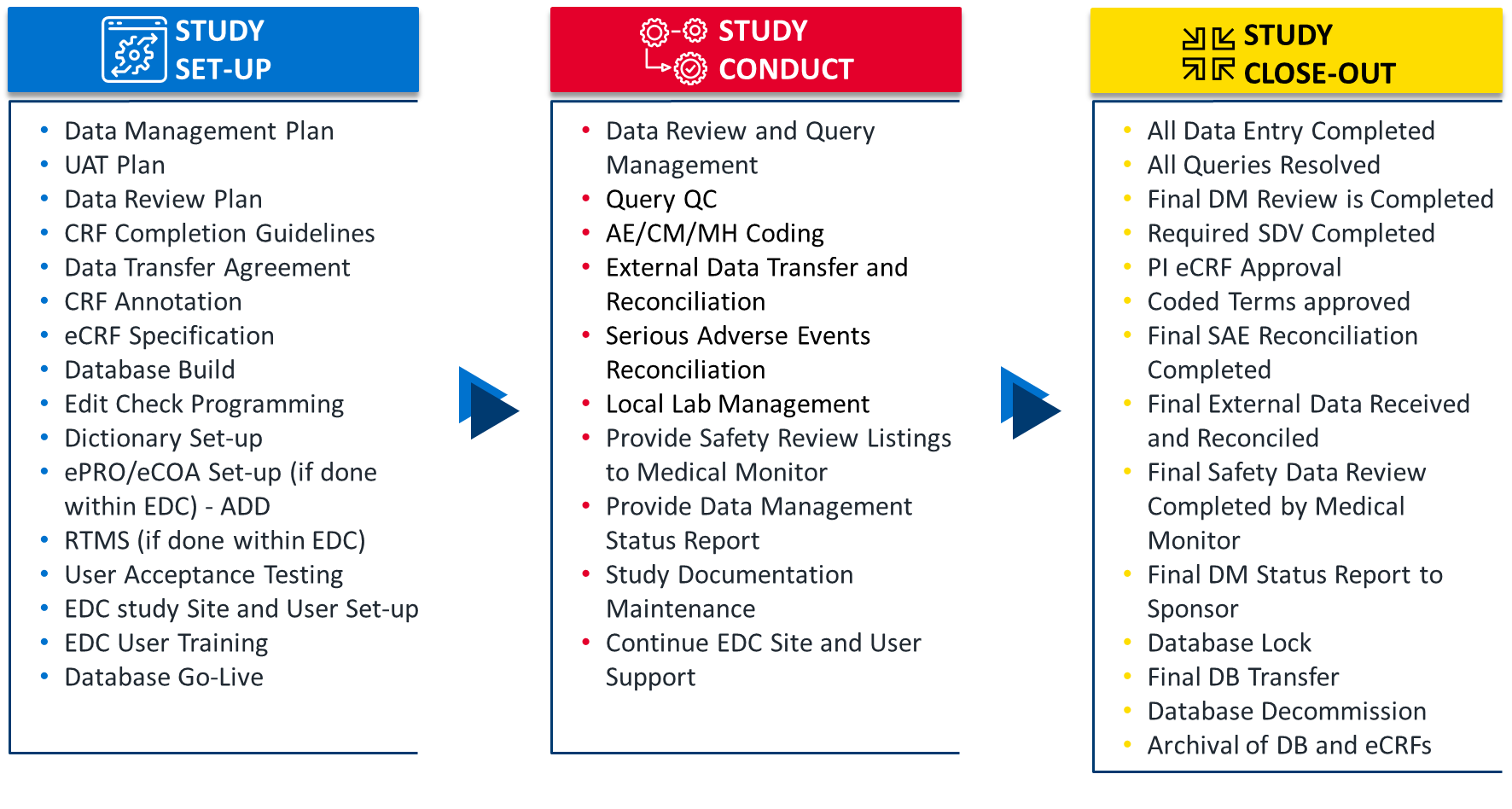
データマネジメントの管理体制
PM、CRA、プログラマー、統計解析担当者、メディカルライターと積極的に連携し、臨床試験におけるデータマネジメントのニーズを満たし、タイムラインに従って成果物を治験依頼者に提供します。
Our Clinical Pharmacovigilance Services
This is optional text Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod tempor incididunt ut labore et dolore magna aliqua. Ut enim ad minim veniam, quis nostrud exercitation ullamco laboris nisi ut aliquip ex
Lorem Ipsum has been the industry's standard dummy text ever since the 1500s, when an unknown printer took a galley of type and scrambled it to make a type specimen book.
Lorem Ipsum has been the industry's standard dummy text ever since the 1500s, when an unknown printer took a galley of type and scrambled it to make a type specimen book.
Lorem Ipsum has been the industry's standard dummy text ever since the 1500s, when an unknown printer took a galley of type and scrambled it to make a type specimen book.
Lorem Ipsum has been the industry's standard dummy text ever since the 1500s, when an unknown printer took a galley of type and scrambled it to make a type specimen book.
Lorem Ipsum has been the industry's standard dummy text ever since the 1500s, when an unknown printer took a galley of type and scrambled it to make a type specimen book.
Lorem Ipsum has been the industry's standard dummy text ever since the 1500s, when an unknown printer took a galley of type and scrambled it to make a type specimen book.
選ばれる理由
グローバル規模でワンストップ、フルサービス
国際開発体制を整備し、日本を中心としたアジア、欧州、米国の3極でサービスを提供。医薬品開発のプランニングから、モニタリング、薬事、PVなどのフルサービスをワンストップで提供しています。
創薬から臨床開発、育薬までを一気通貫
医薬品開発のプロフェッショナルとして、新薬開発から承認後のライフサイクルマネジメントまで一気通貫でお客様と共に歩み続けて参ります。
高難度の試験実績
アンメット・メディカル・ニーズが高く、治験難易度の高いがん、中枢神経系、免疫疾患などに注力し、豊富な実績を有しています。現在は再生医療や眼科・皮膚科等へ拡大を進めています。
医薬品開発の戦略的パートナーをお探しですか?
リニカルは創薬支援から、臨床開発、製造販売後の育薬まで一気通貫で医薬品開発を支援し、薬剤の価値最大化に貢献します。
01 業務に関するお問い合わせ
02 ソリューションのご提案
03 高品質なサービスの提供
リニカルでは社員一人一人が臨床試験のプロとして、新薬が迅速に市場に投入されることにコミットしています。高い品質で効率的に試験を遂行し、プロジェクトの成功に貢献します。
.webp?width=518&height=780&name=cta-img%20(2).webp)