米欧での実績を活用し医薬品開発のDCTを推進
株式会社リニカル(本社:大阪市淀川区、代表取締役社長 秦野和浩)は、日米欧の治験で実績のある分散型臨床試験(Decentralized Clinical Trial, 以下DCT)に対応したサービスを、医薬品の製造販売後の臨床試験・市販後調査・臨床研究(以下、製販後試験)まで対象を拡大して提供を開始しました。グローバルに展開するCROとして、製販後試験の様々なニーズに応じて、GCP等の基準に適合した適切なシステム選定やベンダーマネジメントを行い、品質と安全性の確保されたDCTの実現をサポートします。リニカルは、治験段階から製販後までのすべての臨床試験においてDCT化を推進することで、試験に参加される多くの被験者の皆様の通院負担を軽減し、医薬品開発の効率化を支援します。
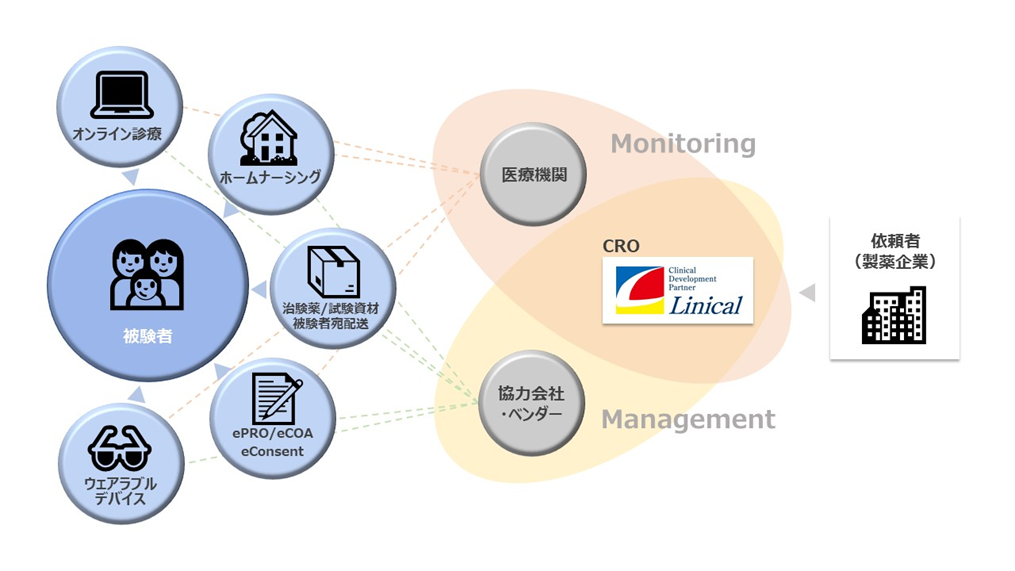
(DCTの実現には様々なシステムを使いながら、関係者間を調整する全体のマネジメントが重要)
製販後試験は、治験の段階ではわからなかった医薬品の有効性や安全性などを、実際の医療行為の中で投与された情報に基づいて調査するもので、新薬開発のための治験よりも多人数のデータ収集が必要となります。よってDCTの活用により、多くの方の試験参加の負担軽減が期待できるほか、アプリやウェアラブルデバイスを活用することで日常のデータを取得できるようになるため、リアルワールドのデータに基づいた詳細な分析が可能となります。
新型コロナウイルス感染症の拡大を契機に、欧米を筆頭に、医薬品の臨床試験をリモート化する検討が進んでいます。しかし実際にDCTを行うには、各国の規制の違いだけでなく、データセキュリティの確保されたプラットフォームの構築、医療施設の既存システムとの連携、そして被験者一人ひとりのご意向など、関係者間のきめ細かなコミュニケーションによって解決すべき事項が多くあります。この中でCROは、臨床開発業務を代行する専門家として、多くの関係者と調整しながら試験全体の設計とマネジメントを行う重要な役目を担うため、製薬企業や医療施設との高いコミュニケーション力と、様々な状況に合わせてDCTをカスタマイズして遂行できる、幅広い知見と柔軟性が求められます。
リニカルは、2011年に日本で、被験者情報を電子的に収集するePROを導入して以来、DCTの受託実績を重ねています。またDCT先進国の欧米では、日本ではまだ普及していないWEBによる被験者の募集から試験データ収集まで完了できるシステムの活用などについても取り組んでいます。こうしたDCT経験に加え、新薬の開発委託業務で培った実績をもとに、育薬事業にも注力して取り組んでおり、製販後試験ならではのニーズにあわせたカスタマイズなど、きめ細かいサービスの提供が可能です。
実際に、複数の日系大手製薬企業が実施する製販後試験において、被験者の皆様から試験への参加同意を電子的に取得するeConsentやウェアラブル端末を導入しました。eConsentについては、ほぼすべての医療施設が初めての導入でしたが、一部で従来型の試験プロセスとの併用を可能とするなど、施設との密なコミュニケーションを図ることで、施設に過度の負荷をかけることなく、クライアントのニーズを満たした試験を実行しています。今後日本でのDCTの進捗に合わせて、欧米で活用されている最先端の技術をリニカルの強みであるコミュニケーション力と組み合わせ、日本の開発環境に合わせたサービスを提供してまいります。
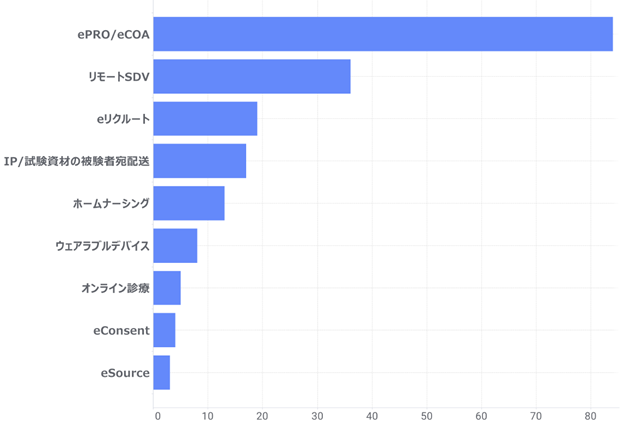
(参考)リニカルのDCT経験社員数(日本、機能別) ※2011~2022年5月末(単位:人)
リニカルについて
株式会社リニカルは、日本発のグローバルCRO(医薬品開発業務受託機関)として、現在、18の国と地域に事業を展開し、医薬品開発を支援しています。治験にかかる多岐にわたる業務を代行するCRO事業を中心に、製造販売後の医薬品の臨床研究・調査を請け負う育薬事業、開発初期における戦略策定や薬事対応などのコンサルティングを行う創薬支援事業の3つの事業を行っています。医薬品開発のプロフェッショナルとして、創薬段階から臨床開発、製造販売後の育薬まで一気通貫でサポートしています。