希少疾患は稀にしか起こらない疾患ですが、その種類は約7,000にものぼります。Genetic and Rare Diseases Information Center(GARD)によると、米国には希少疾患の患者が2500万~3000万人いるとされています。これは米国人の約10人に1人が希少疾患にかかっている計算になります。
希少疾患はいずれも患者数が少ないため、診断が難しく、治療法がなかなか開発されません。これらの疾患は重度のものや、急速に進行し、体を衰弱させ、生涯にわたって続くものが多くあります。希少疾患の場合、正確な診断が得られるまでに平均で5~7年かかります。そのほとんどが遺伝子疾患または遺伝的要素を含むもので、その75%についてはFDAが承認した治療法がありません。多くの希少疾患患者には有効な治療法がほとんど、あるいはまったく無いと言っても過言ではない状況です。有効性が確認された薬が処方されたとしても、それらはFDAの承認なしに使用されることが多く(適応外使用)、そのため、多くの場合は保険が適用されない高価な薬となります。そこには大きなアンメット・メディカル・ニーズがあり、治療法を求めている患者や家族を助けるため、治療法の開発を加速させることが不可欠です。
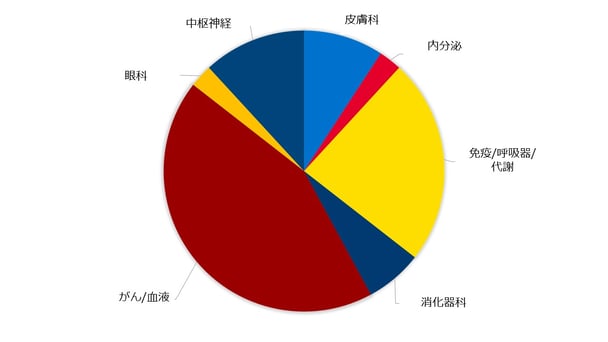
そこで、GCP(医薬品の臨床試験の実施の基準)および米国食品医薬品局(FDA)は最悪の事態を防ぐため、適切かつ迅速な対応をとることを求めています。バイオ製薬会社が行っている希少疾病用医薬品の臨床試験(治験)プロジェクトは現在800を超えています。リニカルはこれまでCROとして、様々な希少疾患の新薬開発に携わっており、現在、希少疾患用の革新的新薬の開発に向けて約70の臨床試験プロジェクトに参加しています※。下の円グラフは当社がこれまでに関わった希少疾患の治療薬の種類を示しています。
希少疾患の治験の難しさ
希少疾患の治療法の開発と評価には臨床試験が不可欠です。希少疾患の患者にとって、薬の臨床試験は患者の日常生活に直接影響を及ぼします。しかし、希少疾患の研究にはいくつかの難しい問題があります。
その一つとして、新薬の開発と製造には多大なコストがかかります。前述のように、ほとんどの希少疾患は遺伝子疾患または遺伝的要素を含む疾患であり、遺伝子治療用の革新的な技術が必要となるために高い製造コストがかかります。特に希少疾患の場合、医薬品の市場規模が基本的に小さく、投資回収の可能性が低いことから、大きな開発コストはネックとなります。希少疾患の臨床試験に必要な研究用インフラは臨床開発プログラムごとに個別に新規開発されることが多く、そのため、治験参加者一人当たりの費用で見た場合、多くの費用のかかる事業となります。そこで、医療開発に利用可能な国内外の研究ネットワークを利用して共同のインフラを構築し、共用する動きがあります。現在では、希少疾患の新薬開発プロセスの効率化に成功している事例が複数あります。
患者にとって、臨床試験は有望な新しい治療法を受ける機会です。しかし、多くの場合、治験参加者を集めることが難しいケースがしばしばです。有意義な結果を得るためには、十分な患者数を確保しなければなりませんが、それが難題です。患者は国内のいたるところ、さらには世界中に散らばっていて、正しく診断されていないことも多々あります。
例えば、糖尿病や高血圧症の患者は沢山いますが、希少疾患の患者は疾患の種類によっては世界中で30人にも満たない場合があり、治験候補者の数ははるかに少ないのです。薬の承認に向けて治験を統計的に有意なものとするためには、一定期間中に一定以上の量の統計データが得られる必要があります。
治験参加者を確保する上でのもう一つの問題は治験への参加希望者が少ないことです。その原因として考えられる要因は、旅費の自己負担が難しい場合があること(臨床試験が実施される施設まで長距離を移動しなければならない場合がある)、さらには、症状によっては患者を移動させるのが難しい場合があるということです。他には、時間がかかりすぎることや、新薬の治験への参加に恐怖を感じる患者がいることがあげられます。
さらに、希少疾患の臨床試験におけるもう一つの大きな問題は、いかに短期間で有効な結果が出せるかです。治験には何年もかかることがあります。その間、世界中の多くの患者を危険な状態にさらすことにもなってしまいます。試験に参加できる患者の数が十分でないと、効果的な薬剤を短期間で生み出すことがますます困難になります。
希少疾患の試験の革新的アプローチとソリューション
希少疾患の臨床試験においては、関わる人が多いほど試験プロセスを早めることが可能になります。現時点では、参加可能な治験プロジェクトに関する情報を患者に常時提供することは難しい状況です。そして、どの治験が一番有望なのかを知ることはさらに困難です。重要なのは臨床試験環境の透明性を高めること、そして、患者と医療提供者がプロジェクトへの参加の適否を正しく判断できるように必要なサポ-トを提供することです。このアプローチはペイシェント・セントリシティ(患者中心主義)と呼ばれています。
これらの問題の解決策として、例えばモバイル技術やウェアラブルの生体センサーを使用して診療を遠隔で行うなど、臨床試験を簡素化するためのソリューションを、研究者や医薬品企業は模索しています。当社の経験から、これまで治験への参加が難しかった希少疾患患者に治験に参加してもらうためには、ハイブリッドな医療形態(現地診療と遠隔診療の融合)が有効であることが分かっています。さらに「治験参加者を中央で選考して自宅付近またはその他の希望の場所の治験責任医師に紹介する方式」は患者にとって利便性が高く、治験参加意向を高めます。
希少疾患の臨床試験の質とタイミングを向上するもう一つの方策は患者支援グループと連携することです。こうしたグループは患者リストを保有しているため、患者の所在地、健康状態、生物学的サンプルデータおよび遺伝的性質の情報を、治験患者募集担当者や研究者が把握しやすくなります。通常、患者支援グループは患者教育を積極的に推進する他、臨床試験への参加機会と試験の安全性について、患者への説明を積極的に行います。患者支援グループと連携することで、より大きな地域をカバーできるようになる他、臨床試験に協力してくれる医療機関や研究者の発掘も容易になります。実際私たちの関わった試験においても、患者支援団体に試験当初から参画してもらい、試験期間中のミーティングにも出席してもらえたプロジェクトはスムーズに進行しています。
希少疾患の安全で効果的な治療方法を開発するための臨床試験は、患者、支援者、医薬品開発者および医療研究者を含め、臨床研究分野の関係者全員による共同作業です。希少疾患の研究を進展させるには、臨床試験を患者に提供するためのアプローチを工夫することをはじめとして、テクノロジーと社会文化どちらの面でもイノベーションが重要です。
筆者:
Diana Davydov, MD
Associate Medical Director - Linical
※記事執筆時点。本記事は2023年8月に英文で作成された記事を翻訳したものです。
.jpg)